药品注册审核从严 药企害怕严惩干脆撤回申请
国家对药品注册从严审核,让越来越多制药企业坐不住了。
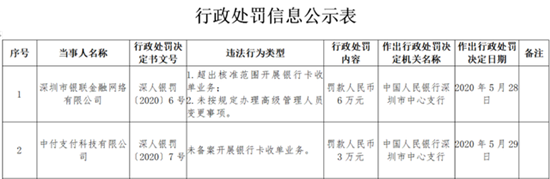
国家食药监总局(CFDA)已经通报了了166家企业撤回药品注册申请,其中有19家是上市公司,还有10家上市药企撤回了药品注册申请但并未发公告。
今年7月22日,CFDA发布了《关于开展药物临床试验数据自查核查工作的公告》,指出为了从源头上保障药品安全、有效,国家食品药品监督管理总局决定对附件所列已申报生产或进口的待审药品注册申请开展药物临床试验数据核查。
这份自查公告也被称“史上最严的数据核查要求”,公告称,“申请人自查发现临床试验数据存在不真实、不完整等问题的,可以在2015年8月25日前向国家食品药品监督管理总局提出撤回注册申请。”如果撤回注册申请,企业必然要损失一大笔前期研发投入。
根据上市公司发布的公告,例如人福药业控股子公司宜昌人福药业有限责任公司撤回的苯磺酸氨氯地平片药品注册的申请,已投入的研发费用约为300万元人民币,而广药白云山旗下的白云山制药总厂撤回的依那普利非洛地平缓释片药品注册申请,也已投入约650万元研发费用。
然而,如果不“忍痛”撤回,可能面临更严重的后果。CFDA表示,对核查中发现临床试验数据真实性存在问题的相关申请人,3年内不受理其申请。药物临床试验机构存在弄虚作假的,吊销药物临床试验机构的资格;对临床试验中存在违规行为的人员通报相关部门依法查处。将弄虚作假的申请人、临床试验机构、合同研究组织以及相关责任人员等列入黑名单。
就在12月7日,CFDA还公布了自查核查的第二批结果,有14家企业13个药品注册申请不予批准,其中包括两家上市医药企业上海医药和博济医药,并且还对涉嫌弄虚作假、违规操作的科研机构予以立案调查。
因此越来越多药企采取了更谨慎的态度。撤回了扎托布洛芬胶囊、扎托布洛芬片两个药品的亚太药业就在公告中表示,公司主动撤回上述药品的注册申请是结合国家药监局最新有关药品的审评审批政策而审慎作出的决定。公司会对上述品种的临床价值和市场前景做进一步评估后,确定是否继续进行深入的研究工作。
事实上,我国药品注册申报积压严重、部分创新药上市审批时间过长,许多仿制药同质化严重、治疗较低的问题一直为人诟病,而国家现在直接从制度源头进行规范。
仿制药是整顿的重点。今年8月18日,国务院就颁布了《关于改革药品医疗器械审评审批制度的意见》,旨在提高药品的质量,促进医药行业产业的结构调整和转型升级。改革的重点包括:提高药品审批质量、解决药品审评的积压、提高仿制药水平、鼓励创新以及提高审评审批的透明度。而改革任务则包括提高药品标准、推进仿制药一次性评价、快创新药的审评审批等12项。
国家食药监总局副局长吴浈还在国务院新闻发布会上重申,力争2018年底前完成国家基本药物口服制剂与参比制剂质量一致性评价。其他仿制药的一致性评价,将逐步在10年内解决。在规定期限内未通过质量一致性评价的仿制药,退出市场。
我国现行的《药品注册管理办法》是2007年7月修订的,2007年以前,我国仿制药并未按照国际化标准进行审批与生产,因而2007年成为仿制药质量一致性评价工作的分水岭。在2007年前,已经有12.2万的化学仿制药已经通过了审批。开展自查后,如果大量低质仿制药主动撤回注册申请,也将减少一致性评价的工作量。夏清逸界面记者





 瑞幸咖啡就财务造假事件致歉
瑞幸咖啡就财务造假事件致歉
 重磅利好出现!金融委再度定
重磅利好出现!金融委再度定
 国产耳机品牌Nank南卡重拳出
国产耳机品牌Nank南卡重拳出
 比特币年内涨幅超过150% 中
比特币年内涨幅超过150% 中
 中兴通讯科技公司将投资146
中兴通讯科技公司将投资146
 宁夏灵武农商银行一董事又“
宁夏灵武农商银行一董事又“
 从特抱抱直播中观带货发展新
从特抱抱直播中观带货发展新
 2017年我国汽车产销量同比增
2017年我国汽车产销量同比增